- m3.comトップ
- > DI Station
- > その他の治療を主目的としない医薬品
- > チャンピックス錠0.5mg 他
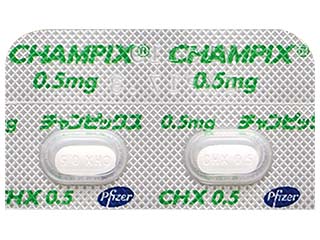

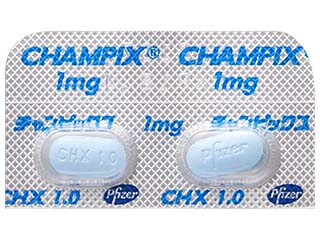
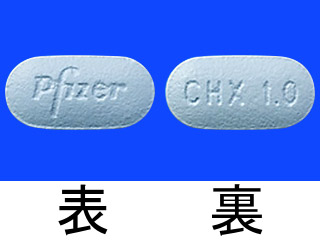
チャンピックス錠0.5mg 他
α4β2ニコチン受容体部分作動薬(禁煙補助薬)
| 一般名 |
バレニクリン酒石酸塩
|
|---|---|
| 製造/販売 | ファイザー |
| 剤形/規格 |
|
警告
-
禁煙は治療の有無を問わず様々な症状を伴うことが報告されており、基礎疾患として有している精神疾患の悪化を伴うことがある。本剤との因果関係は明らかではないが、抑うつ気分、不安、焦燥、興奮、行動又は思考の変化、精神障害、気分変動、攻撃的行動、敵意、自殺念慮及び自殺が報告されているため、本剤を投与する際には患者の状態を十分に観察すること[「重要な基本的注意」の項参照]。
禁忌
-
本剤の成分に対し過敏症の既往歴のある患者
効能・効果
-
ニコチン依存症の喫煙者に対する禁煙の補助
用法・容量
-
通常、成人にはバレニクリンとして第1〜3日目は0.5mgを1日1回食後に経口投与、第4〜7日目は0.5mgを1日2回朝夕食後に経口投与、第8日目以降は1mgを1日2回朝夕食後に経口投与する。なお、本剤の投与期間は12週間とする。
注意事項
重要な基本的注意
-
8.1 医師等により、禁煙治療プログラムに基づいた指導の下に本剤を適切に使用すること。
-
8.2 禁煙は治療の有無を問わず様々な症状(不快、抑うつ気分、不眠、いらだたしさ、欲求不満、怒り、不安、集中困難、落ち着きのなさ、心拍数の減少、食欲増加、体重増加等)を伴うことが報告されており
、基礎疾患として有している精神疾患の悪化を伴うことがある。 -
8.3 抑うつ気分、不安、焦燥、興奮、行動又は思考の変化、精神障害、気分変動、攻撃的行動、敵意、自殺念慮及び自殺が報告されている。本剤との因果関係は明らかではないが、これらの症状があらわれることがあるので、本剤を投与する際には患者の状態を十分に観察すること。なお、本剤中止後もこれらの症状があらわれることがある。また、これらの症状・行動があらわれた場合には本剤の服用を中止し、速やかに医師等に連絡するよう患者に指導すること。
-
8.4 めまい、傾眠、意識障害等があらわれ、自動車事故に至った例も報告されているので、自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。[11.1.3参照]
-
8.5
-
本剤の投与の有無にかかわらず、禁煙により生じる生理的な変化のため、下記のような薬剤の薬物動態や薬力学が変化し、用量調節が必要になる場合がある。
-
テオフィリン、ワルファリン、インスリン等
-
-
また、喫煙によりCYP1A2の活性が誘導されるため、禁煙を開始後、CYP1A2の基質となる薬剤の血漿濃度が上昇する可能性がある。
-
慎重投与
-
9.1 合併症・既往歴等のある患者
-
9.1.1 統合失調症、双極性障害、うつ病等の精神疾患のある患者
-
精神症状を悪化させることがある。
-
-
-
9.2 腎機能障害患者
-
9.2.1 重度の腎機能障害のある患者
-
血中濃度が高くなるおそれがある。[7.6、9.8、10.2、16.6.1参照]
-
-
9.2.2 血液透析を受けている患者
-
本剤を投与する際には十分に観察を行うこと。血中濃度が高くなるおそれがある。[16.6.1参照]
-
-
-
9.5 妊婦
-
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。バレニクリン15mg/kg/日をラットの妊娠〜授乳期間中に経口投与したところ、出生児に体重及び受胎能の低下と聴覚性驚愕反応の亢進が認められた。また、妊娠ウサギにバレニクリン30mg/kg/日を経口投与したところ、胎児の体重低下が認められた。
-
-
9.6 授乳婦
-
授乳中の女性には、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中への本剤の移行は不明であるが、動物実験(ラット)で乳汁中に移行することが報告されている。
-
-
9.7 小児等
-
国内では小児等を対象とした臨床試験は実施していない。
-
-
9.8 高齢者
-
腎機能を確認し、重度腎機能障害が認められた場合には、用量調節を行うこと。本剤は主として腎排泄される。また、高齢者では腎機能が低下していることが多い。[7.6、9.2.1、16.6.1参照]
-
過量投与
-
13.1 処置
-
過量投与後の透析の臨床経験はないが、バレニクリンは透析により除去されることが示されている。[16.6.1参照]
-
適用上の注意
-
14.1 薬剤交付時の注意
-
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
-
その他の注意
-
15.1 臨床使用に基づく情報
-
15.1.1 海外で実施された心血管疾患を有する患者703例を対象とした本剤の有効性評価のためのランダム化二重盲検比較試験において、全試験期間における心血管イベント(心血管死、冠動脈疾患、脳血管疾患、末梢血管疾患)の発生割合は本剤投与群では7.1%(25/353)、プラセボ投与群では5.7%(20/350)[リスク差:1.4%、95%信頼区間−2.3%〜5.0%]であったとの報告がある
。また、上記試験を含む15のランダム化二重盲検比較試験の心血管イベント発生に関する安全性メタ解析において、投与期間及び投与期間+30日における主要心血管イベント(心血管死、非致死性心筋梗塞、非致死性脳卒中)の発生割合及びハザード比は以下の通りであった。 -
投与期間[発生割合:本剤投与群0.17%(7/4190)、プラセボ投与群0.07%(2/2812)、ハザード比:2.83、95%信頼区間0.76〜10.55]
。 -
投与期間+30日[発生割合:本剤投与群0.31%(13/4190)、プラセボ投与群0.21%(6/2812)、ハザード比:1.95、95%信頼区間0.79〜4.82]
。
-
なお、安全性メタ解析に用いた主要心血管イベントは、主として心血管疾患を有する等の高リスク患者で起きたものである。
-
-
15.1.2 海外で実施された12〜19歳の喫煙者312例を対象とした本剤の有効性・安全性評価のための無作為化二重盲検プラセボ対照比較試験において、主要評価項目の投与開始後第9〜12週の4週間持続禁煙率は、バレニクリン群がプラセボ群と比較して統計学的に有意な増加を示さなかった。
-
-
15.2 非臨床試験に基づく情報
-
15.2.1 ラット自己摂取試験の結果から、バレニクリンは強化作用を有するが、その程度はニコチンより弱いことが示された
。また、臨床試験成績から本剤が乱用される可能性は低いことが示された 。 -
15.2.2 バレニクリンを2年間投与したがん原性試験において、雄ラットでは、褐色脂肪腫が5mg/kg/日で65例中1例及び15mg/kg/日で65例中2例にみられた
。本所見とヒトとの関連性は明らかではない。
-
その他の説明
-
25.1 本製剤の薬剤料注)については、ニコチン依存症管理料の算定に伴って処方された場合に限り算定できることとする。また、処方箋による投薬の場合においては、処方箋の「備考」欄に「ニコチン依存症管理料の算定に伴う処方である。」と記載すること。
-
注)「用法及び用量に関連する注意」7.3又は7.4の処方に係る投与については、算定することは出来ない。
-
-
25.2 25.1にかかわらず、ニコチン依存症管理料を算定する禁煙治療を行っている患者が、何らかの理由により入院治療を要することとなった場合、ニコチン依存症管理料の施設基準を届け出ている保険医療機関に入院し、患者本人の強い禁煙意志に基づき禁煙治療を継続した場合に限り、当該禁煙治療に要した本剤の薬剤料を、入院している保険医療機関において算定して差し支えない。
当該薬剤料の算定に当たっては、外来で実施されていた禁煙治療の内容を十分に踏まえ、継続して計画的な禁煙指導を行うために本剤が処方された場合に算定が認められるものであること。
また、診療報酬請求の際には、診療報酬明細書の摘要欄に、「外来にてニコチン依存症管理料の算定患者に対し処方」と記載すること。
なお、入院の期間は、ニコチン依存症管理料の算定期間である12週間には含めないものとし、また、当該入院中の処方については、ニコチン依存症管理料を算定できる治療回数である5回には含めない。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| シメチジン[7.6、9.2.1、16.6.1、16.7.2参照] | 本剤は主として腎排泄される。シメチジンとの併用により、本剤の腎クリアランスが低下して全身曝露量が増加するおそれがあるので、重度の腎機能障害のある患者で併用する場合は注意すること。 | シメチジンが尿細管における本剤の輸送を阻害し、腎クリアランスを低下させる。また、本剤は腎排泄される。 |
副作用
重大な副作用及び副作用用語
重大な副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
11.1.1 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、多形紅斑(頻度不明)
-
皮疹等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
-
-
11.1.2 血管浮腫(頻度不明)
-
顔面、舌、口唇、咽頭、喉頭等の腫脹を症状とする血管浮腫があらわれることがある。
-
-
11.1.3 意識障害(頻度不明)
-
意識レベルの低下、意識消失等の意識障害があらわれることがある。[8.4参照]
-
-
11.1.4 肝機能障害(頻度不明)、黄疸(頻度不明)
-
AST、ALT、γ-GTP等の上昇を伴う肝機能障害、黄疸があらわれることがある。
-
-
発現頻度は、承認時の国内及び外国第II相/第III相試験の結果に基づいている。
その他の副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
| 5%以上 | 0.5%以上5%未満 | 0.5%未満 | 頻度不明 | |
| 感染症及び寄生虫症 | 上気道感染 | 気管支炎 | ||
| 代謝及び栄養障害 | 食欲不振、食欲亢進 | 多飲症 | ||
| 精神障害 | 不眠症(16.3%)、異常な夢(13.0%) | リビドー減退、易刺激性、感情不安定、激越、睡眠障害、不安、抑うつ、落ち着きのなさ | 精神緩慢、気分変動、思考異常、不快気分 | 精神障害、攻撃的行動、敵意 |
| 神経系障害 | 頭痛(11.6%) | 傾眠、振戦、注意力障害、味覚異常、嗜眠 | 協調運動異常、構語障害、感覚鈍麻 | 記憶障害、健忘、一過性健忘、痙攣 |
| 心臓障害 | 心房細動、動悸、狭心症 | |||
| 血管障害 | ほてり、高血圧 | |||
| 眼障害 | 眼痛、羞明、暗点、結膜炎 | |||
| 耳及び迷路障害 | 耳鳴 | |||
| 呼吸器、胸郭及び縦隔障害 | 咽喉刺激感、咳嗽 | 呼吸困難、嗄声、鼻漏、気道うっ血、副鼻腔うっ血、いびき | ||
| 胃腸障害 | 嘔気(28.5%)、鼓腸、便秘 | 胃食道逆流性疾患、胃不快感、下痢、口内乾燥、消化不良、軟便、腹痛、腹部膨満、嘔吐 | おくび、胃炎、歯肉痛、吐血、血便排泄、口内炎 | イレウス |
| 皮膚及び皮下組織障害 | ざ瘡、そう痒症、発疹 | 紅斑、多汗症 | ||
| 筋骨格系及び結合組織障害 | 筋痛、筋痙攣 | 関節硬直、関節痛、背部痛 | ||
| 腎及び尿路障害 | 頻尿・夜間頻尿 | 糖尿、多尿 | ||
| 生殖系及び乳房障害 | 月経過多、性機能不全 | |||
| 全身障害及び投与局所様態 | 胸痛、倦怠感、口渇、無力症、めまい | 胸部不快感、発熱 | 浮腫、末梢性浮腫 | |
| 臨床検査 | 肝機能検査値異常(AST上昇、ALT上昇、ALP上昇、血中ビリルビン上昇) | 心電図ST部分下降、心電図T波振幅減少、心拍数増加、血小板数減少、体重増加 |
-
発現頻度は、承認時の国内及び外国第II相/第III相試験の結果に基づいている。
薬価
チャンピックス錠0.5mg 77.5円/錠
チャンピックス錠1mg 136.1円/錠
m3.comにご登録済の方
薬剤名検索
薬剤情報提供:一般財団法人日本医薬情報センター 剤形写真提供:株式会社薬事日報社
・薬剤情報・剤形写真は月一回更新しておりますが、ご覧いただいた時点で最新情報ではない可能性がございます。 最新情報は、各製薬会社のWebサイトなどでご確認ください。
・投稿内容の中に適応外、承認用法・用量外の記載等が含まれる場合がありますが、エムスリー、製薬会社が推奨するものではありません。

 同薬効薬剤
同薬効薬剤

使いやすさ
投稿日: 2015/01/18 参考率: 100%(9人/9人)
内科/70代/処方経験あり