- m3.comトップ
- > DI Station
- > ヴァイトラックビカプセル25mg 他

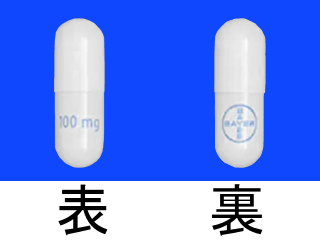

ヴァイトラックビカプセル25mg 他
抗悪性腫瘍剤
| 一般名 |
ラロトレクチニブ硫酸塩
|
|---|---|
| 製造/販売 | バイエル薬品 |
| 剤形/規格 |
|
警告
-
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に本剤の有効性及び危険性を十分説明し、同意を得てから投与すること。
禁忌
-
本剤の成分に対し過敏症の既往歴のある患者
効能・効果
-
NTRK 融合遺伝子陽性の進行・再発の固形癌
用法・容量
-
通常、成人にはラロトレクチニブとして1回100mgを1日2回経口投与する。なお、患者の状態により適宜減量する。
-
通常、小児にはラロトレクチニブとして1回100mg/m2(体表面積)を1日2回経口投与する。ただし、1回100mgを超えないこと。なお、患者の状態により適宜減量する。
注意事項
重要な基本的注意
-
8.1 肝機能障害があらわれることがあるので、本剤投与開始前及び投与中は定期的に肝機能検査を行い、患者の状態を十分に観察すること。[11.1.1参照]
-
8.2 骨髄抑制があらわれることがあるので、本剤投与開始前及び投与中は定期的に血液検査を行い、患者の状態を十分に観察すること。[11.1.2参照]
慎重投与
-
9.3 肝機能障害患者
-
9.3.1 中等度以上の肝機能障害患者(Child-Pugh分類B又はC)
-
減量を考慮するとともに、患者の状態をより慎重に観察し、副作用の発現に十分注意すること。本剤の血漿中濃度が上昇し、副作用が増強されるおそれがある。[16.6.2参照]
-
-
-
9.4 生殖能を有する者
-
妊娠可能な女性には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
-
-
9.5 妊婦
-
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
NTRK1 、NTRK2 及びNTRK3 遺伝子をそれぞれ欠損したノックアウトマウスでは、神経系の異常により生後早期に死亡することが報告されており、本剤の作用機序から、本剤が投与された場合、胎児へ有害な影響を及ぼす可能性がある。[9.4参照]
-
-
9.6 授乳婦
-
授乳しないことが望ましい。乳汁移行に関するデータはないが、本剤はBCRPの基質であるため、乳汁移行の可能性がある。[15.2参照]
-
適用上の注意
-
14.1 薬剤交付時の注意
-
<内用液>
-
14.1.1 凍結を避け、2〜8℃で保存すること。
-
14.1.2 開封後30日以内に使用すること。
-
-
-
14.2 薬剤投与時の注意
-
<カプセル>
-
14.2.1 カプセルは開けたり、噛んだり、つぶしたりせず、そのまま多めの水で服用すること。
-
-
<内用液>
-
14.2.2 ピペットを用いて経口投与する。なお、経鼻又は胃栄養チューブを介して投与することもできる。
-
-
その他の注意
-
15.2 非臨床試験に基づく情報
-
幼若ラットにおいて、本剤を生後7日から反復経口投与した場合、生後9〜16日の間に小児患者の臨床曝露量に対して雄は2.5倍、雌は0.7倍で死亡がみられたことが報告されている。頭部傾斜及び平衡不全が認められた後に死亡した幼若ラットが認められたため、中枢神経系に対する本剤の影響が死亡に至る重篤な状態悪化に関連している可能性がある。[9.6参照]
-
相互作用
相互作用序文
-
本剤は、主にCYP3Aによって代謝される。また、CYP3Aに対して弱い阻害作用を示す。
薬物代謝酵素用語
CYP3A併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 強力な又は中程度のCYP3A阻害剤イトラコナゾール、クラリスロマイシン、ボリコナゾール等グレープフルーツ含有食品[16.7.1、16.7.2参照] | 本剤の副作用が増強されるおそれがあるので、これらの薬剤との併用は可能な限り避け、やむを得ず併用する場合には本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | これらの薬剤がCYP3Aを阻害することにより、本剤の血漿中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 強力な又は中程度のCYP3A誘導剤リファンピシン、フェニトイン、フェノバルビタール等セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品[16.7.3、16.7.4参照] | 本剤の有効性が減弱するおそれがあるので、これらの薬剤との併用は可能な限り避けること。 | これらの薬剤がCYP3Aを誘導することにより、本剤の血漿中濃度が低下する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| CYP3Aの基質となる薬剤シクロスポリン、キニジン、タクロリムス等[16.7.5参照] | これらの薬剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤がCYP3Aを阻害することにより、これらの薬剤の血漿中濃度が上昇する可能性がある。 |
副作用
重大な副作用及び副作用用語
重大な副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
11.1.1 肝機能障害
-
ALT増加(28.0%)、AST増加(23.3%)等を伴う肝機能障害があらわれることがある。[8.1参照]
-
-
11.1.2 骨髄抑制
-
好中球減少(10.6%)、白血球減少(9.0%)、貧血(7.9%)、血小板減少(4.2%)、リンパ球減少(3.7%)等の骨髄抑制があらわれることがある。[8.2参照]
-
-
11.1.3 中枢神経系障害
-
浮動性めまい(17.5%)、錯感覚(2.6%)、歩行障害(1.6%)、運動失調(0.5%)、認知障害(0.5%)等があらわれることがある。
-
その他の副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
| 5%以上 | 5%未満 | |
| 胃腸障害 | 悪心(10.6%)、便秘(10.1%)、味覚異常、嘔吐、下痢 | |
| 筋骨格系および結合組織障害 | 筋肉痛 | 筋力低下 |
| 一般・全身障害および投与部位の状態 | 疲労(14.3%)、浮腫 | |
| 神経系障害 | 頭痛 | |
| 皮膚および皮下組織障害 | 発疹 | |
| その他 | 体重増加 | Al-P増加 |
薬価
ヴァイトラックビカプセル25mg 4042.5円/カプセル
ヴァイトラックビカプセル100mg 14542.9円/カプセル
ヴァイトラックビ内用液20mg/mL 2908.6円/mL
m3.comにご登録済の方
薬剤名検索
薬剤情報提供:一般財団法人日本医薬情報センター 剤形写真提供:株式会社薬事日報社
・薬剤情報・剤形写真は月一回更新しておりますが、ご覧いただいた時点で最新情報ではない可能性がございます。 最新情報は、各製薬会社のWebサイトなどでご確認ください。
・投稿内容の中に適応外、承認用法・用量外の記載等が含まれる場合がありますが、エムスリー、製薬会社が推奨するものではありません。

 同薬効薬剤
同薬効薬剤
