- m3.comトップ
- > DI Station
- > ホルモン剤(抗ホルモン剤を含む)
- > プロペシア錠0.2mg 他
禁忌
-
2.1 本剤の成分に対し過敏症の既往歴のある患者
-
2.2 妊婦又は妊娠している可能性のある女性及び授乳中の女性[8.1、9.5、9.6、14.1参照]
効能・効果
-
男性における男性型脱毛症の進行遅延
用法・容量
-
男性成人には、通常、フィナステリドとして0.2mgを1日1回経口投与する。なお、必要に応じて適宜増量できるが、1日1mgを上限とする。
注意事項
重要な基本的注意
-
8.1 本剤の使用に際しては、患者に次の事項を説明すること。[2.2、9.5、9.6、14.1参照]
-
・本剤を妊婦に投与すると、本剤の薬理作用(DHT低下作用)により、男子胎児の生殖器官等の正常発育に影響を及ぼすおそれがある。
-
・本剤を分割・粉砕しないこと。
本剤が粉砕・破損した場合、妊婦又は妊娠している可能性のある女性及び授乳中の女性は取扱わないこと。本剤はコーティングされているので、割れたり砕けたりしない限り、通常の取扱いにおいて有効成分に接触することはない。
-
-
8.2 本剤との因果関係は明らかではないが、自殺念慮、自殺企図、自殺既遂が報告されている。患者の状態を十分に観察するとともに、自殺念慮又は自殺企図があらわれた場合には本剤の服用を中止し、速やかに医師等に連絡するよう患者に指導すること。[9.1.1参照]
慎重投与
-
9.1 合併症・既往歴等のある患者
-
9.1.1 うつ病、うつ状態又はその既往歴、自殺念慮又は自殺企図の既往歴を有する患者 -
本剤との因果関係は明らかではないが、自殺念慮、自殺企図、自殺既遂が報告されている。[8.2参照]
-
-
-
9.3 肝機能障害患者
-
本剤は主に肝臓で代謝される。肝機能障害患者を対象とした臨床試験は実施していない。
-
-
9.5 妊婦
-
妊婦又は妊娠している可能性のある女性には投与しないこと。[2.2、8.1、14.1参照]
-
-
9.6 授乳婦
-
授乳中の女性には投与しないこと。本剤がヒト乳汁中へ移行するかは不明である。[2.2、8.1、14.1参照]
-
-
9.7 小児等
-
小児等に対する適応はない。小児等を対象とした臨床試験は実施していない。
-
-
9.8 高齢者
-
前立腺肥大症患者を対象にした臨床試験(フィナステリド5mg)では、高齢者と非高齢者において副作用の発現割合に明らかな差は認められていない。しかし、一般に高齢者では生理機能が低下しているので注意すること。
高齢者における有効性は確立していない。
-
適用上の注意
-
14.1 調剤及び服用時の注意
-
本剤を分割・粉砕しないこと。
本剤が粉砕・破損した場合、妊婦又は妊娠している可能性のある女性及び授乳中の女性は取扱わないこと。[2.2、8.1、9.5、9.6参照]
-
-
14.2 薬剤交付時の注意
-
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
-
14.2.2 本剤は、食事の有無にかかわらず投与できる。[16.2.1参照]
-
その他の注意
-
15.1 臨床使用に基づく情報
-
15.1.1 市販後において、本剤を投与された患者で男性乳癌が報告されている。フィナステリド長期投与と男性乳癌の発現との因果関係は不明である。
-
(参考)
-
海外で実施された、3,047例(平均年齢:63歳)の前立腺肥大症患者を対象としたプラセボ及び比較対照薬との4〜6年間の臨床試験において、フィナステリド5mg投与群(本剤承認用量の5〜25倍用量)で4例の乳癌の報告があったが、フィナステリド非投与群ではみられなかった
。一方、別の3,040例(平均年齢:64歳)の前立腺肥大症患者を対象としたプラセボとの4年間の海外臨床試験では、プラセボ投与群において2例の乳癌の報告があったが、フィナステリド5mg投与群ではみられなかった 。また、18,882例(平均年齢:63歳)の健康男性を対象としたプラセボとの7年間の海外臨床試験では、フィナステリド5mg投与群及びプラセボ投与群で各1例ずつ乳癌の報告があった 。なお、海外の市販後において、フィナステリド1日5mgを投与された患者で男性乳癌が報告されている。
-
-
-
15.1.2 海外で実施された、18,882例(平均年齢:63歳)の健康男性を対象としたフィナステリド5mg(本剤承認用量の5〜25倍用量)又はプラセボを7年間投与する臨床試験
において、Modified Gleason Score*8〜10の高悪性度前立腺癌の発現率が、プラセボ投与群(1.1%)と比較して、フィナステリド5mg投与群(1.8%)で高かった(相対リスク1.70[95%信頼区間:1.23-2.34])との報告がある 。 -
*組織学的悪性度の指標
-
-
15.1.3 海外臨床試験において、本剤投与により前立腺容積が減少したとの報告がある。
-
-
15.2 非臨床試験に基づく情報
-
アカゲザルの妊娠20日から100日までフィナステリド120ng/kg/dayを毎日静脈内投与した場合でも雌雄胎児に異常所見は認められなかった(アカゲザルへの投与量は、フィナステリド1mgが投与された患者の1回の射精を介して女性が曝露される可能性のあるフィナステリド量の少なくとも750倍に相当する)
。[16.3.2参照]
-
その他の説明
-
本剤は保険給付の対象とならない(薬価基準未収載)。
相互作用
副作用
重大な副作用及び副作用用語
重大な副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
11.1.1 肝機能障害(頻度不明)
その他の副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | そう痒症、じん麻疹、発疹、血管浮腫(口唇、舌、咽喉及び顔面腫脹を含む) | ||
| 生殖器 | リビドー減退注1) | 勃起機能不全注1)、射精障害注1)、精液量減少 | 睾丸痛、血精液症、男性不妊症・精液の質低下(精子濃度減少、無精子症、精子運動性低下、精子形態異常等)注2) |
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇 | ||
| その他 | 乳房圧痛、乳房肥大、抑うつ症状、めまい |
-
注1)市販後において、投与中止後も持続したとの報告がある。
-
注2)本剤の投与中止後に、精液の質が正常化又は改善されたとの報告がある。
薬価
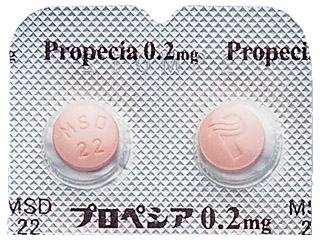
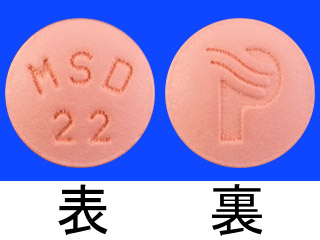
プロペシア錠0.2mg
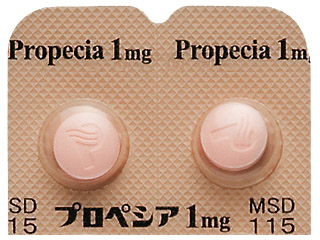
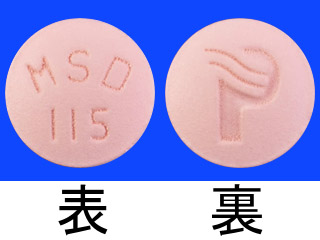
プロペシア錠1mg
m3.comにご登録済の方
薬剤名検索
薬剤情報提供:一般財団法人日本医薬情報センター 剤形写真提供:株式会社薬事日報社
・薬剤情報・剤形写真は月一回更新しておりますが、ご覧いただいた時点で最新情報ではない可能性がございます。 最新情報は、各製薬会社のWebサイトなどでご確認ください。
・投稿内容の中に適応外、承認用法・用量外の記載等が含まれる場合がありますが、エムスリー、製薬会社が推奨するものではありません。

 同薬効薬剤
同薬効薬剤

エビデンスの確かさ・信頼性
投稿日: 2015/03/25 参考率: 89%(8人/9人)
麻酔科/60代/処方経験なし