- m3.comトップ
- > DI Station
- > 循環器官用剤
- > エンレスト錠50mg 他


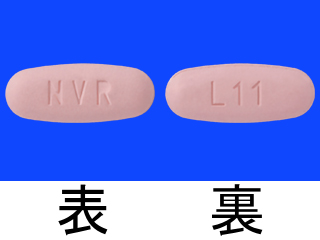

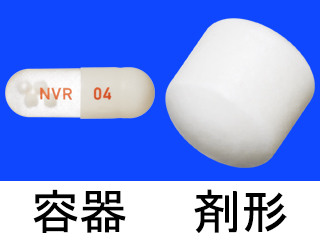

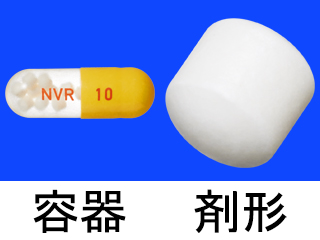
エンレスト錠50mg 他
アンジオテンシン受容体ネプリライシン阻害薬(ARNI)
| 一般名 |
サクビトリルバルサルタンナトリウム水和物
|
|---|---|
| 製造/販売 | ノバルティスファーマ |
| 剤形/規格 |
|
禁忌
-
2.1 本剤の成分に対し過敏症の既往歴のある患者
-
2.2 アンジオテンシン変換酵素阻害薬(アラセプリル、イミダプリル塩酸塩、エナラプリルマレイン酸塩、カプトプリル、キナプリル塩酸塩、シラザプリル水和物、テモカプリル塩酸塩、デラプリル塩酸塩、トランドラプリル、ベナゼプリル塩酸塩、ペリンドプリルエルブミン、リシノプリル水和物)を投与中の患者、あるいは投与中止から36時間以内の患者[5.1、5.3、8.1、10.1参照]
-
2.3 血管
性 浮腫の既往歴のある患者(アンジオテンシンII受容体拮抗薬又はアンジオテンシン変換酵素阻害薬による血管性 浮腫、遺伝性血管性浮腫、後天性血管性 浮腫、特発性血管性 浮腫等)[11.1.1参照] -
2.4 アリスキレンフマル酸塩を投与中の糖尿病患者(ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く)[10.1参照]
-
2.5 重度の肝機能障害(Child-Pugh分類C)のある患者[9.3.1参照]
-
2.6 妊婦又は妊娠している可能性のある女性[9.5参照]
効能・効果
-
エンレスト錠50mg
-
<錠50mg>
-
成人
-
慢性心不全
ただし、慢性心不全の標準的な治療を受けている患者に限る。
-
-
小児
-
慢性心不全
-
-
-
用法・容量
-
エンレスト錠50mg
-
<慢性心不全>
-
通常、成人にはサクビトリルバルサルタンとして1回50mgを開始用量として1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に1回200mgまで増量する。1回投与量は50mg、100mg又は200mgとし、いずれの投与量においても1日2回経口投与する。なお、忍容性に応じて適宜減量する。
-
通常、1歳以上の小児には、サクビトリルバルサルタンとして下表のとおり体重に応じた開始用量を1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に目標用量まで増量する。なお、忍容性に応じて適宜減量する。
-
小児における用量表(1回投与量)
体重 開始用量 第1漸増用量 第2漸増用量 目標用量 40kg未満 0.8mg/kg 1.6mg/kg 2.3mg/kg 3.1mg/kg 40kg以上50kg未満 0.8mg/kg 50mg 100mg 150mg 50kg以上 50mg 100mg 150mg 200mg
-
-
-
(参考)
-
錠50mg 錠100mg 錠200mg 粒状錠小児用12.5mg 粒状錠小児用31.25mg 慢性心不全(成人) ○ ○ ○ − − 慢性心不全(小児) ○ ○ ○ ○ ○ 高血圧症 − ○ ○ − − - ○:承認用法・用量あり、−:承認なし
-
-
注意事項
重要な基本的注意
-
8.1 血管
性 浮腫があらわれるおそれがあるため、本剤投与前にアンジオテンシン変換酵素阻害薬が投与されている場合は、少なくとも本剤投与開始36時間前に中止すること。また、本剤投与終了後にアンジオテンシン変換酵素阻害薬を投与する場合は、本剤の最終投与から36時間後までは投与しないこと。[2.2、5.1、5.3、10.1参照] -
8.2 症候性低血圧があらわれるおそれがあるため、特に投与開始時及び増量時は患者の状態を十分に観察しながら慎重に投与すること。[7.1-7.3、9.1.4、9.8.1、11.1.3参照]
-
8.3 アンジオテンシンII受容体拮抗薬投与中に肝炎等の重篤な肝障害があらわれたとの報告があるので、肝機能検査を実施するなど観察を十分に行うこと。[11.1.12参照]
-
8.4 脱水があらわれるおそれがあるため、観察を十分に行い、異常が認められた場合には、本剤の減量、投与中止や補液等の適切な処置を行うこと。
-
8.5 手術前24時間は投与しないことが望ましい。麻酔及び手術中にレニン−アンジオテンシン系の抑制作用による低血圧を起こす可能性がある。
-
8.6 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
慎重投与
-
9.1 合併症・既往歴等のある患者
-
<効能共通>
-
9.1.1 両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者
-
治療上やむを得ないと判断される場合を除き、投与は避けること。腎血流量の減少や糸球体濾過圧の低下により急速に腎機能を悪化させるおそれがある。
-
-
9.1.2 高カリウム血症の患者
-
治療上やむを得ないと判断される場合を除き、投与は避けること。高カリウム血症を増悪させるおそれがある。
高カリウム血症のリスク因子のある患者(腎機能障害、糖尿病、低アルドステロン症の患者又はカリウム含量が高い食事を摂取している患者等)では、血清カリウム値をモニタリングすること。[10.2、11.1.4参照]
-
-
9.1.3 脳血管障害のある患者
-
本剤の降圧作用により、脳血流不全を引き起こし、病態を悪化させるおそれがある。
-
-
-
<慢性心不全>
-
9.1.4 血圧が低い患者
-
定期的に血圧を測定し、患者の状態を十分に観察しながら投与すること。[7.1、8.2、11.1.3参照]
-
-
-
<高血圧症>
-
9.1.5 厳重な減塩療法中の患者
-
低用量から投与を開始し、増量する場合は徐々に行うこと。急激な血圧低下(失神及び意識消失等を伴う)を起こすおそれがある。[11.1.5参照]
-
-
-
-
9.2 腎機能障害患者
-
<慢性心不全>
-
9.2.1 軽度又は中等度の腎機能障害(eGFR 30mL/min/1.73m2以上90mL/min/1.73m2未満)のある患者
-
血圧、血清カリウム値及び腎機能等の患者の状態を十分に観察しながら投与すること。本剤の血中濃度が上昇するおそれがある。[7.1、11.1.2、16.6.1参照]
-
-
9.2.2 重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者
-
本剤投与の可否を慎重に判断し、投与する場合には血圧、血清カリウム値及び腎機能等の患者の状態を十分に観察すること。本剤の血中濃度が上昇するおそれがあり、臨床試験では除外されている。[7.1、11.1.2、16.6.1参照]
-
-
-
<高血圧症>
-
9.2.3 軽度又は中等度の腎機能障害(eGFR 30mL/min/1.73m2以上90mL/min/1.73m2未満)のある患者
-
血清カリウム値及び腎機能等の患者の状態を十分に観察しながら投与すること。本剤の血中濃度が上昇するおそれがある。[11.1.2、16.6.1参照]
-
-
9.2.4 重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者
-
本剤投与の可否を慎重に判断し、投与する場合には血清カリウム値及び腎機能等の患者の状態を十分に観察すること。低用量から開始することを考慮すること。本剤の血中濃度が上昇するおそれがある。[11.1.2、16.6.1参照]
-
-
9.2.5 血液透析中の患者
-
本剤投与の可否を慎重に判断し、投与する場合には血清カリウム値及び腎機能等の患者の状態を十分に観察すること。低用量から投与を開始し、増量する場合は徐々に行うこと。本剤の血中濃度が上昇するおそれや、急激な血圧低下(失神及び意識消失等を伴う)を起こすおそれがあり、臨床試験では除外されている。[11.1.2、11.1.5参照]
-
-
-
-
9.3 肝機能障害患者
-
<効能共通>
-
9.3.1 重度の肝機能障害(Child-Pugh分類C)のある患者
-
投与しないこと。重度の肝機能障害のある患者では本剤の血中濃度が上昇するおそれがあり、臨床試験では除外されている。[2.5参照]
-
-
-
<慢性心不全>
-
9.3.2 中等度の肝機能障害(Child-Pugh分類B)のある患者
-
本剤投与の可否を慎重に判断し、投与する場合には血圧、血清カリウム値及び腎機能等の患者の状態を十分に観察しながら投与すること。本剤の血中濃度が上昇するおそれがある。[7.1、16.6.2参照]
-
-
-
<高血圧症>
-
9.3.3 中等度の肝機能障害(Child-Pugh分類B)のある患者
-
本剤投与の可否を慎重に判断し、投与する場合には血清カリウム値及び腎機能等の患者の状態を十分に観察しながら投与すること。低用量から開始することを考慮すること。本剤の血中濃度が上昇するおそれがある。[16.6.2参照]
-
-
-
-
9.4 生殖能を有する者
-
9.4.1 妊娠する可能性のある女性
-
妊娠していることが把握されずアンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を使用し、胎児・新生児への影響(腎不全、頭蓋・肺・腎の形成不全、死亡等)が認められた例が報告されている
。
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]-
(1)本剤投与開始前に妊娠していないことを確認すること。本剤投与中も、妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には、直ちに投与を中止すること。
-
(2)次の事項について、本剤投与開始時に患者に説明すること。また、投与中も必要に応じ説明すること。
-
・妊娠中に本剤を使用した場合、胎児・新生児に影響を及ぼすリスクがあること。
-
・本剤投与中及び最終投与後1週間は避妊する必要があること及び適切な避妊法。
-
・妊娠が判明した又は疑われる場合は、速やかに担当医に相談すること。
-
・妊娠を計画する場合は、担当医に相談すること。
-
-
-
-
-
9.5 妊婦
-
妊婦又は妊娠している可能性のある女性には投与しないこと。投与中に妊娠が判明した場合には、直ちに投与を中止すること。本剤を投与した動物実験(ラット、ウサギ)において、サクビトリルの活性代謝物(sacubitrilat)及びバルサルタンの曝露量が、臨床用量投与時の曝露量の0.06倍及び0.72倍(ラット)並びに0.03倍及び2.04倍(ウサギ)に相当する用量から、胚・胎児致死(着床後死亡率の高値)及び催奇形性(水頭症)が認められたとの報告がある。また、バルサルタンを含むアンジオテンシII受容体拮抗薬並びにアンジオテンシン変換酵素阻害薬で、妊娠中期〜末期に投与を受けた妊婦において、母体及び胎児への影響(自然流産、胎児・新生児死亡、羊水過少症、胎児・新生児の低血圧、腎機能障害、腎不全、高カリウム血症、頭蓋の形成不全、羊水過少症によると推測される四肢の拘縮、脳、頭蓋顔面の奇形、肺の発育形成不全等)が報告されている
。[2.6、9.4.1参照]
-
-
9.6 授乳婦
-
授乳しないことが望ましい。本剤のヒトにおける乳汁中への移行は不明であるが、動物実験(ラットの授乳期経口投与)で、乳汁中にsacubitrilat及びバルサルタンの移行が認められた。本剤の投与期間中の授乳により、新生児又は乳児に影響を及ぼすおそれがある。また、バルサルタンの動物実験(ラットの周産期及び授乳期経口投与)において、600mg/kg/日で出生児の低体重及び生存率の低下が認められており、200mg/kg/日以上で外表分化の遅延が認められている。
-
-
9.7 小児等
-
<慢性心不全>
-
9.7.1 低出生体重児、新生児を対象とした臨床試験は実施していない。[17.1.3参照]
-
-
<高血圧症>
-
9.7.2 小児等を対象とした臨床試験は実施していない。
-
-
-
9.8 高齢者
-
<慢性心不全>
-
9.8.1 血圧、血清カリウム値及び腎機能等の患者の状態を十分に観察しながら投与すること。特に投与開始時及び増量時は患者の状態を観察しながら慎重に投与すること。一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。臨床試験において、高齢者では、低血圧、高カリウム血症、腎機能障害の発現が増加することが報告されている。[8.2、11.1.2-11.1.4、16.6.3参照]
-
-
<高血圧症>
-
9.8.2 低用量から投与を開始するなど慎重に投与すること。一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。[16.6.3参照]
-
-
過量投与
-
13.1 症状
-
本剤の過量投与により、著しい血圧低下が生じ、意識レベルの低下、循環虚脱に至るおそれがある。
-
-
13.2 処置
-
著しい低血圧の場合には、患者を仰臥位にし、速やかに生理食塩液等の静脈注射など適切な処置を行うこと。
なお、sacubitrilat及びバルサルタンは血漿蛋白との結合率が高く、血液透析によって除去できない。[16.3参照]
-
適用上の注意
-
14.1 薬剤調製時の注意
-
<粒状錠小児用>
-
PTPシートから取り出して調剤しないこと。
-
-
-
14.2 薬剤交付時の注意
-
<製剤共通>
-
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
-
-
<粒状錠小児用>
-
14.2.2 以下の使用方法を十分指導すること。
-
・粒状錠の投与直前に指示された種類及び数のカプセル型容器をPTPシートから取り出すこと。
-
・絶対にカプセル型容器ごと飲ませないこと。
-
・粒状錠をカプセル型容器から取り出す際は、白色(粒状錠小児用12.5mg)又は黄色(粒状錠小児用31.25mg)のキャップを上にして慎重に開封すること。
-
・粒状錠小児用は、1錠単位ではなく1カプセル単位(粒状錠小児用12.5mgは4錠、粒状錠小児用31.25mgは10錠)で含量を管理していることから、1回の投与時にカプセル型容器内の粒状錠はすべて投与することとし、1つのカプセル型容器内の粒状錠を分割して投与しないこと。[7.4参照]
-
-
-
その他の注意
-
15.2 非臨床試験に基づく情報
-
サクビトリルの幼若ラットを用いた毒性試験において、骨量及び骨長の減少、並びに体重増加抑制が認められた。これらの所見に関して、小児の臨床用量での安全域は確保されていない。
-
相互作用
相互作用序文
-
Sacubitrilat及びバルサルタンはOATP1B1及びOATP1B3の基質である。なお、サクビトリル及びsacubitrilatはOATP1B1及びOATP1B3を阻害する。
薬物代謝酵素用語
OATP1B1薬物代謝酵素用語
OATP1B3併用禁忌
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アンジオテンシン変換酵素阻害薬アラセプリル(セタプリル)イミダプリル塩酸塩(タナトリル)エナラプリルマレイン酸塩(レニベース)カプトプリル(カプトリル)キナプリル塩酸塩(コナン)シラザプリル水和物(インヒベース)テモカプリル塩酸塩(エースコール)デラプリル塩酸塩(アデカット)トランドラプリル(オドリック)ベナゼプリル塩酸塩(チバセン)ペリンドプリルエルブミン(コバシル)リシノプリル水和物(ゼストリル、ロンゲス)[2.2、8.1参照] | 血管性浮腫があらわれるおそれがある。これらの薬剤が投与されている場合は、少なくとも本剤投与開始36時間前に中止すること。また、本剤投与終了後にこれらの薬剤を投与する場合は、本剤の最終投与から36時間後までは投与しないこと。 | 併用により相加的にブラジキニンの分解を抑制し、血管性浮腫のリスクを増加させる可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アリスキレンフマル酸塩(ラジレス)(糖尿病患者に投与する場合。ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く。)[2.4参照] | 非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加がバルサルタンで報告されている。 | 併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。 |
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アンジオテンシンII受容体拮抗薬 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがあるため、これらの薬剤と併用すべきでない。 | 併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アリスキレンフマル酸塩 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。なお、eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については、治療上やむを得ないと判断される場合を除き避けること。 | 併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アトルバスタチン[16.7.1参照] | 併用によりアトルバスタチンの血中濃度が上昇するおそれがある。 | 本剤は、OATP1B1及びOATP1B3を介する薬剤の肝臓への取り込みを阻害する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| PDE5阻害剤シルデナフィル等 | 高血圧症患者において、本剤とシルデナフィルとの併用により、本剤単独投与よりも血圧低下が認められたとの報告がある。本剤の投与を受けている患者においてシルデナフィル又は他のPDE5阻害剤の投与を開始する際には注意すること。 | PDE5阻害剤は本剤の投与により増加するcGMPの分解を阻害する。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| カリウム保持性利尿薬トリアムテレンスピロノラクトンエプレレノン等カリウム補給製剤塩化カリウム[9.1.2参照] | 血清カリウム値及び血清クレアチニン値が上昇するおそれがある。 | 本剤のアルドステロン分泌抑制によりカリウム貯留作用が増強する可能性がある。危険因子:腎機能障害 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ドロスピレノン・エチニルエストラジオール | 血清カリウム値が上昇することがある。 | バルサルタンによる血清カリウム値の上昇とドロスピレノンの抗ミネラルコルチコイド作用によると考えられる。危険因子:腎障害患者、血清カリウム値の高い患者 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| トリメトプリム含有製剤スルファメトキサゾール・トリメトプリム | 血清カリウム値が上昇することがある。 | 血清カリウム値の上昇が増強されるおそれがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| シクロスポリン | 血清カリウム値が上昇することがある。 | 高カリウム血症の副作用が相互に増強されると考えられる。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 利尿降圧剤フロセミドトリクロルメチアジド等[11.1.5参照] | 急激な血圧低下(失神及び意識消失等を伴う)を起こすおそれがある。また、利尿作用が増強されるおそれがある。高血圧症患者においては、低用量から本剤の投与を開始し、増量する場合は徐々に行うこと。 | 利尿降圧剤投与中は血漿レニン活性が上昇しており、これらの薬剤との併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。重度のナトリウムないし体液量の減少した患者では、まれに症候性の低血圧が生じることがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 非ステロイド性消炎鎮痛剤(NSAIDs)インドメタシン等 | 本剤の降圧作用が減弱することがある。 | NSAIDsの腎プロスタグランジン合成阻害作用により、本剤の降圧作用が減弱することがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 非ステロイド性消炎鎮痛剤(NSAIDs)インドメタシン等 | 腎機能を悪化させるおそれがある。 | NSAIDsの腎プロスタグランジン合成阻害作用により、腎血流量が低下するためと考えられる。危険因子:高齢者、体液量が減少している患者(利尿薬使用患者を含む)、腎機能障害患者 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| リチウム | リチウム中毒を起こすことがレニン−アンジオテンシン−アルドステロン系阻害剤で報告されている。利尿薬を使用する場合には、リチウム毒性のリスクがさらに増加するおそれがある。 | 本剤のナトリウム排泄作用により、リチウムの蓄積が起こると考えられている。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| シクロスポリンクラリスロマイシンエリスロマイシン | Sacubitrilat又はバルサルタンの曝露量が増加し、副作用が増強されるおそれがある。 | OATP1B1又はOATP1B3を阻害することにより、sacubitrilat及びバルサルタンの血中濃度を上昇させる可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ビキサロマー | バルサルタンの血中濃度が約30〜40%に低下したとの報告がある。本剤の作用が減弱するおそれがある。 | リン酸結合性ポリマーにより、同時に服用した場合、バルサルタンの吸収を遅延あるいは減少させる可能性がある。 |
副作用
重大な副作用及び副作用用語
重大な副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
11.1.1 血管
性 浮腫(0.2%)-
舌、声門、喉頭の腫脹等を症状として、気道閉塞につながる血管
性 浮腫があらわれることがある。このような場合には直ちに投与を中止し、アドレナリン注射、気道確保等適切な処置を行うこと。血管性 浮腫が消失しても再投与しないこと。また、腹痛、嘔気、嘔吐、下痢等を伴う腸管血管性浮腫があらわれることがある。 [2.3参照]
-
-
11.1.2 腎機能障害(2.4%)、腎不全(0.6%)[9.2.1-9.2.5、9.8.1参照]
-
11.1.3 低血圧(8.8%)[7.1、8.2、9.1.4、9.8.1参照]
-
11.1.4 高カリウム血症(3.9%)
-
高カリウム血症が発現した場合には、カリウム摂取量の減量など適切な処置を行うこと。[9.1.2、9.8.1参照]
-
-
11.1.5 ショック(0.1%未満)、失神(0.2%)、意識消失(0.1%未満)
-
冷感、嘔吐、意識消失等があらわれた場合には、直ちに適切な処置を行うこと。[9.1.5、9.2.5、10.2参照]
-
-
11.1.6 無顆粒球症注)(頻度不明)、白血球減少注)(0.1%未満)、血小板減少注)(頻度不明)
-
11.1.7 間質性肺炎注)(0.1%未満)
-
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、このような場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
-
-
11.1.8 低血糖注)(頻度不明)
-
脱力感、空腹感、冷汗、手の震え、集中力低下、痙攣、意識障害等があらわれた場合には投与を中止し、適切な処置を行うこと。糖尿病治療中の患者であらわれやすい。
-
-
11.1.9 横紋筋融解症注)(頻度不明)
-
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがあるので、このような場合には直ちに投与を中止し、適切な処置を行うこと。
-
-
11.1.10 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)注)、皮膚粘膜眼症候群(Stevens-Johnson症候群)注)、多形紅斑注)(いずれも頻度不明)
-
11.1.11 天疱瘡注)、類天疱瘡注)(いずれも頻度不明)
-
水疱、びらん等があらわれた場合には、皮膚科医と相談すること。
-
-
11.1.12 肝炎注)(頻度不明)[8.3参照]
-
注)バルサルタンの使用上の注意を踏まえて設定した。
その他の副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
| 0.3%以上 | 0.3%未満 | 頻度不明 | |
| 感染症および寄生虫症 | − | − | 咽頭炎注) |
| 血液およびリンパ系障害 | − | 貧血注)、好酸球増多注) | − |
| 代謝および栄養障害 | − | 低カリウム血症、食欲減退注)、低ナトリウム血症注) | − |
| 神経系障害 | 浮動性めまい | 体位性めまい、回転性めまい、頭痛、不眠注)、味覚異常注)、眠気注)、しびれ注) | − |
| 耳および迷路障害 | − | − | 耳鳴注) |
| 心臓障害 | − | 動悸注)、心房細動注) | 頻脈注) |
| 血管障害 | 起立性低血圧 | − | ほてり注) |
| 呼吸器、胸郭および縦隔障害 | 咳嗽 | − | − |
| 胃腸障害 | − | 下痢、悪心、腹痛注)、便秘注)、嘔吐注) | − |
| 皮膚および皮下組織障害 | − | 蕁麻疹注) | 紅斑注)、光線過敏症注) |
| 筋骨格系および結合組織障害 | − | 関節痛注)、腰背部痛注) | 筋肉痛注) |
| 一般・全身障害および投与部位の状態 | 疲労 | 無力症、けん怠感注)、口渇注)、胸痛注) | 浮腫注)、発熱注) |
| 免疫系障害 | − | 過敏症(発疹、そう痒症、アナフィラキシー反応を含む) | − |
| 臨床検査 | − | AST上昇注)、ALT上昇注)、血中尿酸値上昇注)、BUN上昇注)、血清クレアチニン上昇注)、血清カリウム値上昇注)、血糖値上昇注)、CK上昇注) | ビリルビン値の上昇注)、LDH上昇注)、血清コレステロール上昇注)、血清総蛋白減少注)、ALP上昇注) |
-
注)バルサルタンの使用上の注意を踏まえて設定した。
薬価
エンレスト錠50mg 60.9円/錠
エンレスト錠100mg 106.9円/錠
エンレスト錠200mg 188.2円/錠
エンレスト粒状錠小児用12.5mg 21.4円/個
エンレスト粒状錠小児用31.25mg 43.2円/個
m3.comにご登録済の方
薬剤名検索
薬剤情報提供:一般財団法人日本医薬情報センター 剤形写真提供:株式会社薬事日報社
・薬剤情報・剤形写真は月一回更新しておりますが、ご覧いただいた時点で最新情報ではない可能性がございます。 最新情報は、各製薬会社のWebサイトなどでご確認ください。
・投稿内容の中に適応外、承認用法・用量外の記載等が含まれる場合がありますが、エムスリー、製薬会社が推奨するものではありません。

 同薬効薬剤
同薬効薬剤
