- m3.comトップ
- > DI Station
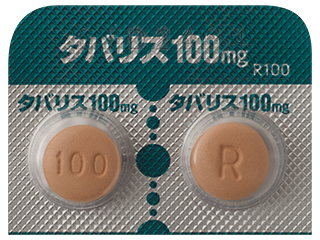
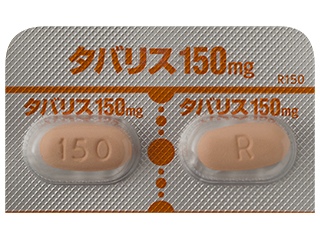
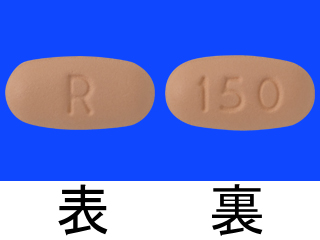
- > タバリス錠100mg 他

禁忌
-
2.1 本剤の成分に対し過敏症の既往歴のある患者
-
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
効能・効果
-
慢性特発性血小板減少性紫斑病
用法・容量
-
通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。
注意事項
重要な基本的注意
-
8.1 本剤は、血液疾患の治療に十分な経験を持つ医師のもとで使用すること。
-
8.2 血小板数が少なくとも50,000/μL以上に安定するまで、2週間ごとに血液学的検査を実施し、安定した後は定期的に血液学的検査を実施すること。血小板数の増加に伴い、血栓症又は血栓塞栓症のリスクが増加する可能性があることから、観察を十分に行い、異常が認められた場合は適切な処置を行うこと。[7.1、7.3参照]
-
8.3 本剤の投与により血圧上昇があらわれることがあるので、血圧が安定するまでは2週間ごとに血圧を測定し、安定した後は定期的に測定すること。[7.1、7.5、11.1.2参照]
-
8.4 本剤の投与により好中球数減少があらわれることがあるので、2週間ごとに好中球数を測定し、安定した後は定期的に測定すること。[7.1、7.5、11.1.3参照]
-
8.5 本剤の投与により肝機能障害があらわれることがあるので、2週間ごとにAST、ALT及びビリルビンなどの肝機能検査を実施し、安定した後は定期的に肝機能検査を実施すること。[7.1、7.5、11.1.5、12.、16.7.6参照]
-
8.6 本剤の投与により感染症があらわれることがあるので、定期的に血液検査を実施し、観察を十分に行うこと。[11.1.4参照]
慎重投与
-
9.1 合併症・既往歴等のある患者
-
9.1.1 血栓症又は血栓塞栓症の既往歴(動脈及び静脈血栓塞栓症など)や素因(第V因子ライデン変異、アンチトロンビンIII欠損症など)を有する患者
-
血栓塞栓症があらわれるおそれがある。血栓症又は血栓塞栓症の既往歴や素因を有する患者を対象とした臨床試験は実施していない。
-
-
9.1.2 B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)
-
患者の臨床症状と臨床検査値の観察を十分に行い、B型肝炎の再燃の徴候に注意すること。
-
-
-
9.3 肝機能障害患者
-
9.3.1 重度の肝機能障害患者(Child-Pugh分類C)
-
本剤投与の可否を慎重に判断し、投与する場合には初回投与量の減量を考慮するとともに、患者の状態を十分に観察しながら慎重に投与すること。非結合形R406の血中濃度が上昇するおそれがある。[16.6.2参照]
-
-
-
9.4 生殖能を有する者
-
本剤投与中及び最終投与後一定期間は適切な避妊を徹底するように指導すること。ヒトの受胎能への影響に関するデータは得られていない。動物実験(雌ラット)において受胎率の低下が報告されていることから、本剤は女性の受胎能に影響を及ぼす可能性がある。[9.5参照]
-
-
9.5 妊婦
-
妊婦又は妊娠している可能性のある女性には投与しないこと。また、投与中に妊娠が判明した場合には、直ちに投与を中止すること。海外の臨床試験において、妊娠した患者で死産/自然流産の報告がある。動物実験(ラット及びウサギ)において、臨床推奨用量を下回る曝露で胚・胎児死亡率の増加、胎児の低体重並びに骨格及び内臓異常(変異及び奇形)が認められた。[2.2、9.4参照]
-
-
9.6 授乳婦
-
授乳しないことが望ましい。動物実験(ラット)において、乳汁中への移行が報告されている。また、動物実験(ラット)において、乳汁を介した曝露に起因すると考えられる出生児の死亡率の増加及び低体重が認められた。
-
-
9.7 小児等
-
小児等を対象とした臨床試験は実施していない。動物実験(ラット、マウス及び幼若ウサギ)において、活発に成長している骨への影響として、大腿骨頭の軟骨形成異常、大腿骨近位及び大腿脛骨関節の成長板異形成、並びに大腿骨及び胸骨の骨髄細胞密度の減少が認められた。
-
-
9.8 高齢者
-
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
-
適用上の注意
-
14.1 薬剤調製時の注意
-
PTPシートから取り出し一包化調剤することは避けること。[20.参照]
-
-
14.2 薬剤交付時の注意
-
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
-
取扱上の注意
-
本剤は吸湿により溶出性に影響を及ぼすことがあるため、アルミピロー開封後はPTPシートの状態で保存すること。[14.1参照]
相互作用
相互作用序文
-
ホスタマチニブはP-糖蛋白質(P-gp)及び乳がん耐性蛋白質(BCRP)に対して阻害作用を有する。また、本剤の活性本体であるR406は主としてCYP3A4により代謝され、BCRPに対して阻害作用を有し、CYP3Aに対して弱い阻害作用を有する。
薬物代謝酵素用語
P-糖蛋白質(P-gp)薬物代謝酵素用語
乳がん耐性蛋白質(BCRP)薬物代謝酵素用語
CYP3A4薬物代謝酵素用語
CYP3A併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 強いCYP3A阻害剤イトラコナゾールクラリスロマイシンリトナビル 等[16.7.1参照] | R406の血漿中濃度が上昇し、本剤の副作用が増強される可能性がある。併用時には患者の状態を慎重に観察して副作用の発現に十分注意し、必要に応じて本剤の減量を考慮すること。 | これらの薬剤の強いCYP3A阻害作用による。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 強いCYP3A誘導剤カルバマゼピンフェニトインリファンピシン 等[16.7.2参照] | R406の血漿中濃度が低下し、本剤の効果が減弱する可能性がある。本剤投与時はこれらの薬剤等を投与しないことが望ましい。 | これらの薬剤の強いCYP3A誘導作用による。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| シンバスタチン[16.7.3参照] | シンバスタチン及びシンバスタチン酸の血漿中濃度が上昇し、副作用が増強される可能性がある。併用時には患者の状態を慎重に観察して副作用の発現に十分注意し、必要に応じてシンバスタチンの減量を考慮すること。 | ホスタマチニブ及びR406はBCRPの阻害作用を有し、R406はCYP3Aの弱い阻害作用を有する。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ジゴキシン[16.7.4参照] | ジゴキシンの血漿中濃度が上昇し、副作用が増強される可能性がある。併用時には患者の状態を慎重に観察して副作用の発現に十分注意し、必要に応じてジゴキシンの減量を考慮すること。 | ホスタマチニブはP-gpの阻害作用を有する。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ロスバスタチン[16.7.5参照] | ロスバスタチンの血漿中濃度が上昇し、副作用が増強される可能性がある。併用時には患者の状態を慎重に観察して副作用の発現に十分注意し、必要に応じてロスバスタチンの減量を考慮すること。 | ホスタマチニブ及びR406はBCRPの阻害作用を有する。 |
副作用
重大な副作用及び副作用用語
重大な副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
11.1.1 重度の下痢(1.7%)
-
必要に応じて電解質や腎機能検査を行い、患者の状態により止瀉薬の投与、補液などの適切な処置を行うこと。[7.1、7.5参照]
-
-
11.1.2 高血圧
-
高血圧(21.2%)、高血圧クリーゼ(0.6%)があらわれることがある。必要に応じて降圧剤の投与などの適切な処置を行うこと。[7.1、7.5、8.3参照]
-
-
11.1.3 好中球減少
-
好中球減少(5.6%)、発熱性好中球減少症(0.6%)があらわれることがある。[7.1、7.5、8.4参照]
-
-
11.1.4 感染症
-
肺炎(1.1%)等の感染症があらわれることがある。患者の状態を十分観察し、異常が認められた場合は、抗菌剤の投与などの適切な処置を行うこと。[8.6参照]
-
-
11.1.5 肝機能障害(17.3%)
-
ALT(8.4%)、AST(5.6%)、ビリルビン(2.2%)等の上昇を伴う肝機能障害があらわれることがある。[7.1、7.5、8.5、12.参照]
-
その他の副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
| 10%以上 | 5〜10%未満 | 5%未満 | |
| 神経系 | 浮動性めまい | ||
| 消化器 | 下痢(31.3%)、悪心 | 腹痛 | |
| 皮膚 | 発疹 | ||
| 臨床検査 | 白血球減少 | ||
| その他 | 胸痛、疲労 |
薬価
タバリス錠100mg 4188円/錠
タバリス錠150mg 6226.8円/錠
m3.comにご登録済の方
薬剤名検索
薬剤情報提供:一般財団法人日本医薬情報センター 剤形写真提供:株式会社薬事日報社
・薬剤情報・剤形写真は月一回更新しておりますが、ご覧いただいた時点で最新情報ではない可能性がございます。 最新情報は、各製薬会社のWebサイトなどでご確認ください。
・投稿内容の中に適応外、承認用法・用量外の記載等が含まれる場合がありますが、エムスリー、製薬会社が推奨するものではありません。

 同薬効薬剤
同薬効薬剤
