- m3.comトップ
- > DI Station
- > 抗生物質製剤
- > ボノサップパック400 他

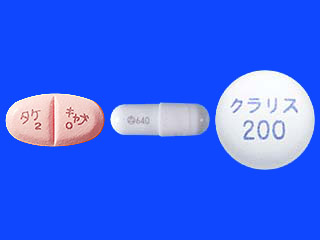
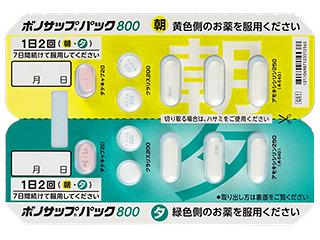
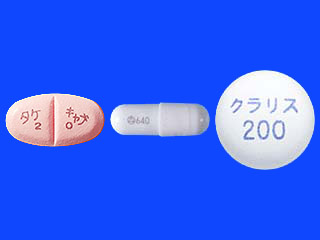
禁忌
-
2.1 本製品に包装されている各製剤の成分に対する過敏症の既往歴のある患者
-
2.2 アタザナビル硫酸塩、リルピビリン塩酸塩、ピモジド、エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミンメシル酸塩、スボレキサント
、ダリドレキサント塩酸塩、ボルノレキサント水和物 、ロミタピドメシル酸塩、タダラフィル〔アドシルカ〕、チカグレロル、イブルチニブ、イバブラジン塩酸塩、ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)、再発又は難治性のマントル細胞リンパ腫 の用量漸増期)、ルラシドン塩酸塩、アナモレリン塩酸塩、フィネレノン、イサブコナゾニウム硫酸塩、ボクロスポリン、マバカムテン を投与中の患者[10.1参照] -
2.3 肝臓又は腎臓に障害のある患者で、コルヒチンを投与中の患者[9.2.1、9.3.1、10.2参照]
-
2.4 伝染性単核症のある患者[アモキシシリン水和物で紅斑性丘疹の発現頻度が高いとの報告がある。]
-
2.5 高度の腎障害のある患者[9.2.2参照]
効能・効果
-
<適応菌種>
-
アモキシシリン、クラリスロマイシンに感性のヘリコバクター・ピロリ
-
-
<適応症>
-
胃潰瘍・十二指腸潰瘍・胃MALTリンパ腫・
免疫性血小板減少症 ・早期胃癌に対する内視鏡的治療後胃におけるヘリコバクター・ピロリ感染症、ヘリコバクター・ピロリ感染胃炎
-
用法・容量
-
通常、成人にはボノプラザンとして1回20mg、アモキシシリン水和物として1回750mg(力価)及びクラリスロマイシンとして1回200mg(力価)の3剤を同時に1日2回、7日間経口投与する。なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、1回400mg(力価)1日2回を上限とする。
注意事項
重要な基本的注意
-
8.1 本製品に包装されている個々の製剤を単独、もしくは本製品の効能又は効果以外の目的に使用しないこと。また、用法及び用量のとおり、同時に服用すること。
-
<アモキシシリン水和物>
-
8.2 ショック、アナフィラキシー、アレルギー反応に伴う急性冠症候群、薬剤により誘発される胃腸炎症候群の発生を確実に予知できる方法はないが、事前に当該事象の既往歴等について十分な問診を行うこと。なお、抗生物質によるアレルギー歴は必ず確認すること。[9.1.1、11.1.5-11.1.7参照]
-
8.3 急性腎障害等の重篤な腎障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.9参照]
-
8.4 顆粒球減少、血小板減少があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.10参照]
-
-
<クラリスロマイシン>
-
8.5 血小板減少、汎血球減少、溶血性貧血、白血球減少、無顆粒球症があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.18参照]
-
慎重投与
-
9.1 合併症・既往歴等のある患者
-
<アモキシシリン水和物>
-
9.1.1 ペニシリン系又はセフェム系抗生物質に対し過敏症の既往歴のある患者(ただし、アモキシシリン水和物に対し過敏症の既往歴のある患者には投与しないこと)[8.2参照]
-
9.1.2 本人又は両親、兄弟に気管支喘息、発疹、じん麻疹等のアレルギー症状を起こしやすい体質を有する患者
-
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
-
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
-
-
-
<クラリスロマイシン>
-
9.1.4 他のマクロライド系薬剤に対する過敏症の既往歴のある患者
-
9.1.5 心疾患のある患者、低カリウム血症のある患者
-
QT延長、心室頻拍(Torsade de pointesを含む)、心室細動を起こすことがある。[11.1.16参照]
-
-
-
-
9.2 腎機能障害患者
-
ボノプラザンの排泄が遅延することにより血中濃度が上昇することがある。また、クラリスロマイシンの血中濃度が上昇するおそれがある。[16.6.1参照]
-
9.2.1 腎機能障害患者でコルヒチンを投与中の患者
-
投与しないこと。クラリスロマイシンとの併用によるコルヒチンの血中濃度上昇に伴う中毒症状が報告されている。[2.3、10.2参照]
-
-
9.2.2 高度の腎機能障害患者
-
投与しないこと。アモキシシリン水和物、クラリスロマイシンの血中濃度が上昇することがあり、本製品では各製剤の投与量を調節できない。[2.5参照]
-
-
-
9.3 肝機能障害患者
-
ボノプラザンの代謝、排泄が遅延することにより血中濃度が上昇することがある。また、クラリスロマイシンにより肝機能障害を悪化させることがある。[11.1.17、16.6.2参照]
-
9.3.1 肝機能障害患者でコルヒチンを投与中の患者
-
投与しないこと。クラリスロマイシンとの併用によるコルヒチンの血中濃度上昇に伴う中毒症状が報告されている。[2.3、10.2参照]
-
-
-
9.5 妊婦
-
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
-
<ボノプラザンフマル酸塩>
-
9.5.1 動物試験(ラット)において、40mg/日でのヒトにおけるボノプラザンの曝露量(AUC)の約28倍を超える曝露量で、胎児体重及び胎盤重量の低値、外表異常(肛門狭窄及び尾の異常)、並びに内臓異常(膜性部心室中隔欠損及び鎖骨下動脈起始異常)が認められている。
-
-
<クラリスロマイシン>
-
9.5.2 母動物に毒性があらわれる高用量において、胎児毒性(心血管系の異常、口蓋裂、発育遅延等)が報告されている。なお、国外における試験で次のような報告がある。SD系ラット(15〜150mg/kg/日)及びCD-1系マウス(15〜1,000mg/kg/日)において、それぞれ母動物に毒性があらわれる最高用量でラット胎児に心血管系異常並びにマウス胎児に口蓋裂が認められた。また、サル(35〜70mg/kg/日)において、母動物に毒性があらわれる70mg/kg/日で9例中1例に低体重の胎児がみられたが、外表、内臓、骨格には異常は認められなかった。
-
-
-
9.6 授乳婦
-
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
-
<ボノプラザンフマル酸塩>
-
9.6.1
健康授乳婦にボノプラザン20mgを1日1回又は1日2回4日間経口投与したとき、それぞれ投与量の0.012%又は0.023%が母乳中に移行した 。
-
-
<アモキシシリン水和物>
-
9.6.2 外国人データで母乳中へ移行することが報告されている
。
-
-
<クラリスロマイシン>
-
9.6.3 ヒト母乳中へ移行することが報告されており、また、動物試験(ラット)の乳汁中濃度は、血中濃度の約2.5倍で推移した。
-
-
-
9.7 小児等
-
小児等を対象とした臨床試験は実施していない。
-
-
9.8 高齢者
-
一般に肝機能、腎機能等の生理機能が低下している。アモキシシリン水和物による副作用が発現しやすく、クラリスロマイシンの高い血中濃度が持続するおそれがある。また、アモキシシリン水和物によるビタミンK欠乏による出血傾向があらわれることがある。[16.6.3参照]
-
適用上の注意
-
14.1 薬剤交付時の注意
-
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
-
その他の注意
-
15.1 臨床使用に基づく情報
-
<ボノプラザンフマル酸塩>
-
15.1.1 ボノプラザンの投与が胃癌による症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
-
15.1.2 海外における複数の観察研究で、プロトンポンプインヒビターによる治療において骨粗鬆症に伴う股関節骨折、手関節骨折、脊椎骨折のリスク増加が報告されている。特に、高用量及び長期間(1年以上)の治療を受けた患者で、骨折のリスクが増加した。
-
15.1.3 海外における主に入院患者を対象とした複数の観察研究で、プロトンポンプインヒビターを投与した患者においてクロストリジウム・ディフィシルによる胃腸感染のリスク増加が報告されている。
-
-
-
15.2 非臨床試験に基づく情報
-
<ボノプラザンフマル酸塩>
-
15.2.1 マウス及びラット2年間経口投与がん原性試験において、20mg/日でのヒトにおけるボノプラザンの曝露量(AUC)と等倍程度の曝露量で胃の神経内分泌腫瘍が、約300倍で胃の腺腫(マウス)が、また、約13倍以上(マウス)及び約58倍以上(ラット)で肝臓腫瘍が認められている。
-
-
<アモキシシリン水和物、クラリスロマイシン>
-
15.2.2 ラットにアモキシシリン水和物(2,000mg/kg/日)、ランソプラゾール(15mg/kg/日以上)を4週間併用経口投与した試験、及びイヌにアモキシシリン水和物(500mg/kg/日)、ランソプラゾール(100mg/kg/日)、クラリスロマイシン(25mg/kg/日)を4週間併用経口投与した試験で、アモキシシリン水和物を単独あるいは併用投与した動物に結晶尿が認められているが、結晶はアモキシシリン水和物が排尿後に析出したものであり、体内で析出したものではないことが確認されている。
-
-
取扱上の注意
-
アルミ袋を開封後も湿気を避けて保存すること。本品は高防湿性の内袋により品質保持をはかっている。
相互作用
相互作用序文
-
<ボノプラザンフマル酸塩>
-
主として肝薬物代謝酵素CYP3A4で代謝され、一部CYP2B6、CYP2C19及びCYP2D6で代謝される。また、ボノプラザンは弱いCYP3A4阻害作用を有する。
ボノプラザンの胃酸分泌抑制作用により、併用薬剤の吸収を促進又は抑制する可能性がある。
-
-
<クラリスロマイシン>
-
主としてCYP3Aにより代謝され
、CYP3A、P-糖蛋白質(P-gp)を阻害する 。
-
薬物代謝酵素用語
CYP3A4薬物代謝酵素用語
CYP2B6薬物代謝酵素用語
CYP2C19薬物代謝酵素用語
CYP2D6薬物代謝酵素用語
CYP3A薬物代謝酵素用語
P-糖蛋白質(P-gp)併用禁忌
-
<ボノプラザンフマル酸塩>
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アタザナビル硫酸塩(レイアタッツ)[2.2参照] | アタザナビル硫酸塩の作用を減弱するおそれがある。 | ボノプラザンの胃酸分泌抑制作用によりアタザナビル硫酸塩の溶解性が低下し、アタザナビルの血中濃度が低下する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| リルピビリン塩酸塩(エジュラント)[2.2参照] | リルピビリン塩酸塩の作用を減弱するおそれがある。 | ボノプラザンの胃酸分泌抑制作用によりリルピビリン塩酸塩の吸収が低下し、リルピビリンの血中濃度が低下する可能性がある。 |
-
<クラリスロマイシン>
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ピモジド[2.2参照] | QT延長、心室性不整脈(Torsade de pointesを含む)等の心血管系副作用が報告されている。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン〔クリアミン〕ジヒドロエルゴタミンメシル酸塩[2.2参照] | 血管攣縮等の重篤な副作用を起こすおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| スボレキサント〔ベルソムラ〕ダリドレキサント塩酸塩〔クービビック〕ボルノレキサント水和物〔ボルズィ〕[2.2参照] | 左記薬剤の血漿中濃度が顕著に上昇し、その作用が著しく増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ロミタピドメシル酸塩〔ジャクスタピッド〕[2.2参照] | ロミタピドの血中濃度が著しく上昇するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| タダラフィル〔アドシルカ〕[2.2参照] | 左記薬剤のクリアランスが高度に減少し、その作用が増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| チカグレロル〔ブリリンタ〕[2.2参照] | チカグレロルの血漿中濃度が著しく上昇するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| イブルチニブ〔イムブルビカ〕[2.2参照] | イブルチニブの作用が増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| イバブラジン塩酸塩〔コララン〕[2.2参照] | 過度の徐脈があらわれることがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)、再発又は難治性のマントル細胞リンパ腫の用量漸増期)〔ベネクレクスタ〕[2.2参照] | 腫瘍崩壊症候群の発現が増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ルラシドン塩酸塩〔ラツーダ〕[2.2参照] | ルラシドンの血中濃度が上昇し、作用が増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アナモレリン塩酸塩〔エドルミズ〕[2.2参照] | アナモレリンの血中濃度が上昇し、副作用の発現が増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| フィネレノン〔ケレンディア〕[2.2参照] | フィネレノンの血中濃度が著しく上昇するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| イサブコナゾニウム硫酸塩〔クレセンバ〕[2.2参照] | イサブコナゾールの血中濃度が上昇し作用が増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ボクロスポリン〔ルプキネス〕[2.2参照] | ボクロスポリンの血中濃度が上昇し、その作用が増強するおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| マバカムテン〔カムザイオス〕[2.2参照] | マバカムテンの血中濃度が上昇し、副作用が増強され、収縮機能障害による心不全のリスクが高まるおそれがある。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害され、それらの血中濃度が上昇する可能性がある。 |
併用注意
-
<ボノプラザンフマル酸塩>
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| CYP3A4阻害剤クラリスロマイシン等[16.7.1参照] | ボノプラザンの血中濃度が上昇する可能性がある。 | クラリスロマイシンとの併用によりボノプラザンの血中濃度が上昇したとの報告がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ジゴキシンメチルジゴキシン | 左記薬剤の作用を増強する可能性がある。 | ボノプラザンの胃酸分泌抑制作用によりジゴキシンの加水分解が抑制され、ジゴキシンの血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| イトラコナゾールチロシンキナーゼ阻害剤ゲフィチニブニロチニブエルロチニブネルフィナビルメシル酸塩 | 左記薬剤の作用を減弱する可能性がある。 | ボノプラザンの胃酸分泌抑制作用により左記薬剤の血中濃度が低下する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| CYP3A4で代謝される薬剤ミダゾラム等[16.7.2参照] | 左記薬剤の作用を増強する可能性がある。 | ボノプラザンのCYP3A4に対する弱い阻害作用により、左記薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 強い又は中程度のCYP3A4誘導剤リファンピシンエファビレンツ等[16.7.3参照] | ボノプラザンの血中濃度が低下する可能性がある。 | 左記薬剤のCYP3A4に対する誘導作用により、ボノプラザンの代謝が促進される可能性がある。 |
-
<アモキシシリン水和物>
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ワルファリンカリウム | ワルファリンカリウムの作用が増強されるおそれがある。 | 腸内細菌によるビタミンKの産生を抑制することがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 経口避妊薬 | 経口避妊薬の効果が減弱するおそれがある。 | 腸内細菌叢を変化させ、経口避妊薬の腸肝循環による再吸収を抑制すると考えられている。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| プロベネシド | アモキシシリン水和物の血中濃度を増加させる。 | アモキシシリン水和物の尿細管分泌を阻害し、尿中排泄を低下させると考えられている。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| メトトレキサート | メトトレキサートの副作用を増強させるおそれがある。 | メトトレキサートの尿細管分泌を阻害し、尿中排泄を低下させると考えられている。 |
-
<クラリスロマイシン>
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ジゴキシン | 嘔気、嘔吐、不整脈等が報告されているので、ジゴキシンの血中濃度の推移、自覚症状、心電図等に注意し、異常が認められた場合には、投与量を調節する等の適切な処置を行うこと。 | クラリスロマイシンの腸内細菌叢に対する影響により、ジゴキシンの不活化が抑制されるか、もしくはP-gpを介したジゴキシンの輸送が阻害されることにより、その血中濃度が上昇する。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| スルホニル尿素系血糖降下剤グリベンクラミドグリクラジドグリメピリド等 | 低血糖(意識障害に至ることがある)が報告されているので、異常が認められた場合には、投与を中止し、ブドウ糖の投与等の適切な処置を行うこと。 | 機序は不明である。左記薬剤の血中濃度が上昇する可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| カルバマゼピンテオフィリンアミノフィリン水和物シクロスポリンタクロリムス水和物エベロリムス | 左記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので、左記薬剤の血中濃度の推移等に注意し、異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| アトルバスタチンカルシウム水和物シンバスタチンロバスタチン(国内未承認) | 左記薬剤の血中濃度上昇に伴う横紋筋融解症が報告されているので、異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。腎機能障害のある患者には特に注意すること。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| コルヒチン[2.3、9.2.1、9.3.1参照] | コルヒチンの血中濃度上昇に伴う中毒症状(汎血球減少、肝機能障害、筋肉痛、腹痛、嘔吐、下痢、発熱等)が報告されているので、異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ベンゾジアゼピン系薬剤CYP3Aで代謝される薬剤トリアゾラム、ミダゾラム等非定型抗精神病薬CYP3Aで代謝される薬剤クエチアピンフマル酸塩アリピプラゾールブロナンセリン等ジソピラミドトルバプタンエプレレノンエレトリプタン臭化水素酸塩カルシウム拮抗剤CYP3Aで代謝される薬剤ニフェジピン、ベラパミル塩酸塩等リオシグアトジエノゲストホスホジエステラーゼ5阻害剤シルデナフィルクエン酸塩、タダラフィル〔シアリス、ザルティア〕等クマリン系抗凝血剤ワルファリンカリウム等ドセタキセル水和物アベマシクリブオキシコドン塩酸塩水和物フェンタニル/フェンタニルクエン酸塩 | 左記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので、異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。なお、トルバプタンにおいては、クラリスロマイシンとの併用は避けることが望ましいとされており、やむを得ず併用する場合においては、トルバプタンの用量調節を特に考慮すること。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の維持投与期、再発又は難治性のマントル細胞リンパ腫の維持投与期、急性骨髄性白血病) | ベネトクラクスの副作用が増強するおそれがあるので、ベネトクラクスを減量するとともに、患者の状態を慎重に観察すること。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 抗凝固剤CYP3Aで代謝され、P-gpで排出される薬剤アピキサバン、リバーロキサバン | 左記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので、異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。 | クラリスロマイシンのCYP3A及びP-gpに対する阻害作用により、左記薬剤の代謝及び排出が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 抗凝固剤P-gpで排出される薬剤ダビガトランエテキシラート、エドキサバントシル酸塩水和物 | 左記薬剤の血中濃度上昇に伴う作用の増強等の可能性があるので、異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。 | クラリスロマイシンのP-gpに対する阻害作用により、左記薬剤の排出が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| イトラコナゾールHIVプロテアーゼ阻害剤リトナビルロピナビル・リトナビルダルナビル エタノール付加物等 | クラリスロマイシンの未変化体の血中濃度上昇による作用の増強等の可能性がある。また、イトラコナゾールの併用においては、イトラコナゾールの血中濃度上昇に伴う作用の増強等の可能性がある。異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。 | クラリスロマイシンと左記薬剤のCYP3Aに対する阻害作用により、相互に代謝が阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| リファブチンエトラビリン | 左記薬剤の血中濃度上昇に伴う作用の増強等の可能性がある。また、クラリスロマイシンの未変化体の血中濃度が低下し、活性代謝物の血中濃度が上昇し、クラリスロマイシンの作用が減弱する可能性がある。異常が認められた場合には、投与量の調節や中止等の適切な処置を行うこと。 | クラリスロマイシンのCYP3Aに対する阻害作用により、左記薬剤の代謝が阻害される。また、左記薬剤のCYP3A4に対する誘導作用により、クラリスロマイシンの代謝が促進される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| リファンピシンエファビレンツネビラピン | クラリスロマイシンの未変化体の血中濃度が低下し、活性代謝物の血中濃度が上昇する可能性がある。クラリスロマイシンの作用が減弱する可能性があるので、投与量の調節や中止等の適切な処置を行うこと。 | 左記薬剤のCYP3A4に対する誘導作用により、クラリスロマイシンの代謝が促進される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| 天然ケイ酸アルミニウム | クラリスロマイシンの吸収が低下するとの報告がある。 | 左記薬剤の吸着作用によるものと考えられる。 |
副作用
重大な副作用及び副作用用語
重大な副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
<ボノプラザンフマル酸塩>
-
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
-
11.1.2 汎血球減少、無顆粒球症、白血球減少、血小板減少(いずれも頻度不明)
-
11.1.3 肝機能障害(頻度不明)
-
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
-
-
<アモキシシリン水和物>
-
11.1.5 ショック、アナフィラキシー(いずれも0.1%未満注1))
-
不快感、口内異常感、眩暈、便意、耳鳴、発汗、喘鳴、呼吸困難、血管浮腫、全身の潮紅・じん麻疹等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.2参照]
-
-
11.1.6 アレルギー反応に伴う急性冠症候群(頻度不明)[8.2参照]
-
11.1.7 薬剤により誘発される胃腸炎症候群(頻度不明)
-
投与から数時間以内の反復性嘔吐を主症状とし、下痢、嗜眠、顔面蒼白、低血圧、腹痛、好中球増加等を伴う、食物蛋白誘発性胃腸炎に類似したアレルギー性の胃腸炎(Drug-induced enterocolitis syndrome)があらわれることがある。主に小児で報告されている。[8.2参照]
-
-
11.1.8 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも0.1%未満注1))、多形紅斑、急性汎発性発疹性膿疱症、紅皮症(剥脱性皮膚炎)(いずれも頻度不明)
-
発熱、頭痛、関節痛、皮膚や粘膜の紅斑・水疱、膿疱、皮膚の緊張感・灼熱感・疼痛等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
-
-
11.1.9 急性腎障害等の重篤な腎障害(0.1%未満注1))[8.3参照]
-
11.1.10 顆粒球減少(0.1%未満注1))、血小板減少(頻度不明)[8.4参照]
-
11.1.11 偽膜性大腸炎等の血便を伴う重篤な大腸炎(0.1%未満注1))
-
腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
-
-
11.1.12 肝機能障害、黄疸(いずれも0.1%未満)
-
AST、ALTの上昇等を伴う肝機能障害、黄疸があらわれることがある。
-
-
11.1.13 間質性肺炎、好酸球性肺炎(いずれも頻度不明)
-
咳嗽、呼吸困難、発熱等が認められた場合には、速やかに胸部X線、胸部CT等の検査を実施すること。間質性肺炎、好酸球性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
-
-
11.1.14 無菌性髄膜炎(頻度不明)
-
項部硬直、発熱、頭痛、悪心・嘔吐あるいは意識混濁等を伴う無菌性髄膜炎があらわれることがある。
-
-
注1)発現頻度はアモキシシリン水和物の承認時までの臨床試験又は製造販売後調査の結果に基づく。
-
-
<クラリスロマイシン>
-
11.1.15 ショック、アナフィラキシー(いずれも頻度不明)
-
呼吸困難、痙攣、発赤等があらわれることがある。
-
-
11.1.16 QT延長、心室頻拍(Torsade de pointesを含む)、心室細動(いずれも頻度不明)
-
QT延長等の心疾患のある患者、低カリウム血症のある患者においては特に注意すること。[9.1.5参照]
-
-
11.1.17 劇症肝炎、肝機能障害、黄疸、肝不全(いずれも頻度不明)
-
劇症肝炎、AST、ALT、γ-GTP、LDH、AL-Pの上昇等を伴う肝機能障害、黄疸、肝不全があらわれることがある。[9.3参照]
-
-
11.1.18 血小板減少、汎血球減少、溶血性貧血、白血球減少、無顆粒球症(いずれも頻度不明)[8.5参照]
-
11.1.19 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
-
異常が認められた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
-
-
11.1.20 PIE症候群・間質性肺炎(いずれも頻度不明)
-
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等があらわれることがある。このような症状があらわれた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
-
-
11.1.21 偽膜性大腸炎、出血性大腸炎(いずれも頻度不明)
-
偽膜性大腸炎、出血性大腸炎等の重篤な大腸炎があらわれることがある。腹痛、頻回の下痢があらわれた場合には、投与を中止し、適切な処置を行うこと。
-
-
11.1.22 横紋筋融解症(頻度不明)
-
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇があらわれることがある。横紋筋融解症による急性腎障害の発症に注意すること。
-
-
11.1.23 痙攣(頻度不明)
-
痙攣(強直間代性、ミオクロヌス、意識消失発作等)があらわれることがある。
-
-
11.1.24 急性腎障害、尿細管間質性腎炎(いずれも頻度不明)
-
乏尿等の症状や血中クレアチニン値上昇等の腎機能低下所見が認められた場合には、投与を中止し、適切な処置を行うこと。
-
-
11.1.25 IgA血管炎(頻度不明)
-
11.1.26 薬剤性過敏症症候群
(頻度不明) -
初期症状として発疹、発熱がみられ、さらに肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
-
-
その他の副作用
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
<胃潰瘍又は十二指腸潰瘍におけるヘリコバクター・ピロリ感染症>
| 5%以上 | 0.1〜5%未満 | |
| 消化器 | 下痢(10.6%) | 味覚異常、口内炎、腹部不快感、腹部膨満感 |
| 過敏症 | 発疹 | |
| 肝臓 | AST、ALTの上昇 |
-
表中の頻度表示は胃潰瘍又は十二指腸潰瘍におけるボノプラザンフマル酸塩、アモキシシリン水和物及びクラリスロマイシンの3剤投与の試験成績に基づく。
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
ボノプラザンフマル酸塩、アモキシシリン水和物及びクラリスロマイシンでは、他にもそれぞれに次の副作用が認められている。
-
<ボノプラザンフマル酸塩>
| 0.1〜5%未満 | |
| 消化器 | 便秘、下痢、腹部膨満感、悪心 |
| 過敏症 | 発疹 |
| 肝臓 | AST、ALT、AL-P、LDH、γ-GTPの上昇 |
| その他 | 浮腫、好酸球増多 |
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
ボノプラザンフマル酸塩、アモキシシリン水和物及びクラリスロマイシンでは、他にもそれぞれに次の副作用が認められている。
-
<アモキシシリン水和物>
| 0.1〜5%未満注2) | 0.1%未満注2) | 頻度不明注2) | |
| 過敏症 | 発熱、発疹、じん麻疹 | そう痒 | |
| 血液 | 好酸球増多、貧血 | ||
| 肝臓 | AST、ALTの上昇 | ||
| 消化器 | 下痢、悪心、食欲不振 | 黒毛舌 | |
| 菌交代症 | 口内炎、大腸炎(カンジダ、非感受性のクレブシエラ等による) | ||
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| その他 | 梅毒患者の場合:ヤーリッシュ・ヘルクスハイマー反応(発熱、全身倦怠感、頭痛等の発現、病変部の悪化) |
-
注2)頻度表示はアモキシシリン水和物の承認時までの臨床試験又は製造販売後調査の結果に基づく。
-
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
-
ボノプラザンフマル酸塩、アモキシシリン水和物及びクラリスロマイシンでは、他にもそれぞれに次の副作用が認められている。
-
<クラリスロマイシン>
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | そう痒感 | |
| 精神神経系 | めまい、頭痛 | 幻覚、失見当識、意識障害、せん妄、躁病、眠気、振戦、しびれ(感)、錯感覚、不眠 | |
| 感覚器 | 味覚異常(にがみ等) | 耳鳴、聴力低下、嗅覚異常 | |
| 消化器 | 悪心、嘔吐、胃部不快感、腹部膨満感、腹痛、下痢 | 食欲不振、軟便、口内炎、舌炎、口渇 | 口腔内びらん、胸やけ、歯牙変色、舌変色 |
| 血液 | 好酸球増多 | ||
| 肝臓 | AST、ALT、γ-GTP、LDH、AL-P上昇 | ||
| 筋・骨格 | 筋肉痛 | ||
| その他 | 倦怠感、浮腫、カンジダ症、発熱 | 動悸、CK上昇、脱毛、頻尿、低血糖 |
薬価
ボノサップパック400 464.6円/シート
ボノサップパック800 584.1円/シート
m3.comにご登録済の方
薬剤名検索
薬剤情報提供:一般財団法人日本医薬情報センター 剤形写真提供:株式会社薬事日報社
・薬剤情報・剤形写真は月一回更新しておりますが、ご覧いただいた時点で最新情報ではない可能性がございます。 最新情報は、各製薬会社のWebサイトなどでご確認ください。
・投稿内容の中に適応外、承認用法・用量外の記載等が含まれる場合がありますが、エムスリー、製薬会社が推奨するものではありません。

 同薬効薬剤
同薬効薬剤
