- m3.comトップ
- > DI Station
- > 化学療法剤
- > ゾフルーザ錠10mg 他
警告
-
本剤の投与にあたっては,本剤の必要性を慎重に検討すること。[「効能・効果に関連する使用上の注意」の項参照]
禁忌
-
本剤の成分に対し過敏症の既往歴のある患者
効能・効果
-
A型又はB型インフルエンザウイルス感染症
用法・容量
-
通常,成人及び12歳以上の小児には,20mg錠2錠(バロキサビル マルボキシルとして40mg)を単回経口投与する。ただし,体重80kg以上の患者には20mg錠4錠(バロキサビル マルボキシルとして80mg)を単回経口投与する。
-
通常,12歳未満の小児には,以下の用量を単回経口投与する。
-
体重 用量 40kg以上 20mg錠2錠(バロキサビル マルボキシルとして40mg) 20kg以上40kg未満 20mg錠1錠(バロキサビル マルボキシルとして20mg) 10kg以上20kg未満 10mg錠1錠(バロキサビル マルボキシルとして10mg)
-
注意事項
重要な基本的注意
-
抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず,インフルエンザ罹患時には,異常行動 を発現した例が報告されている。[「重大な副作用」の項参照] -
異常行動による転落等の万が一の事故を防止するための予防的な対応として,[1]異常行動の発現のおそれがあること,[2]自宅において療養を行う場合,少なくとも
発熱から 2日間,保護者等は転落等の事故に対する防止対策を講じること, について患者・家族に対し説明を行うこと。 -
なお,転落等の事故に至るおそれのある重度の異常行動については,就学以降の小児・未成年者の男性で報告が多いこと,発熱から2日間以内に発現することが多いこと,が知られている。
-
-
細菌感染症がインフルエンザウイルス感染症に合併したり,インフルエンザ様症状と混同されることがある。細菌感染症の場合には,抗菌剤を投与するなど適切な処置を行うこと。[「効能・効果に関連する使用上の注意」の項参照]
慎重投与
-
重度の肝機能障害のある患者[使用経験がない。(「薬物動態」の項参照)]
過量投与
-
本剤の過量投与に関する情報は得られていないが,副作用があらわれた場合には,症状に応じて適切な処置を行うこと。
適用上の注意
-
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
-
ラットにおいて本薬投与によりプロトロンビン時間(PT)及び活性化部分トロンボプラスチン時間(APTT)の延長が認められたが,ビタミンKとの併用時にはPT及びAPTTの延長は認められなかったとの報告がある
。
相互作用
副作用
副作用発現状況の概要
-
成人及び12歳以上の小児を対象とした臨床試験における安全性評価対象例910例中,臨床検査値の異常変動を含む副作用は49例(5.4%)に認められた。主なものは,下痢12例(1.3%),ALT(GPT)増加8例(0.9%)であった。(承認時)
-
12歳未満の小児を対象とした臨床試験における安全性評価対象例105例中,臨床検査値の異常変動を含む副作用は4例(3.8%)に認められた。主なものは,下痢2例(1.9%)であった。(承認時)
重大な副作用及び副作用用語
重大な副作用
-
異常行動(頻度不明) 因果関係は不明であるものの,インフルエンザ罹患時には,転落等に至るおそれのある異常行動(急に走り出す,徘徊する等)があらわれることがある。[「重要な基本的注意」の項参照]
その他の副作用
| 1%以上 | 1%未満 | |
| 精神神経系 | 頭痛 | |
| 消化器 | 下痢 | |
| その他 | ALT(GPT)増加,AST(GOT)増加 |
薬価
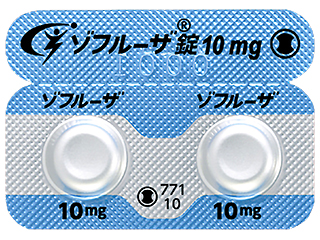
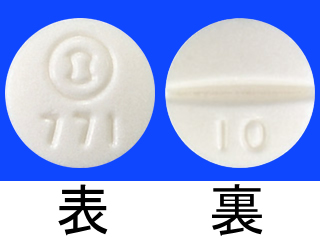
ゾフルーザ錠10mg 1507.5円/錠
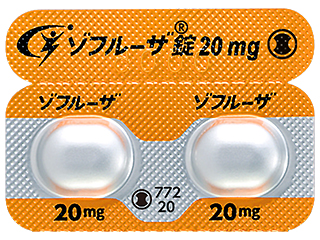
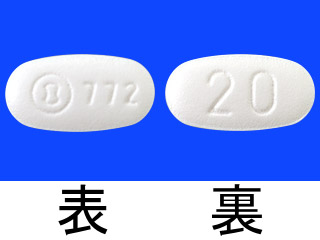
ゾフルーザ錠20mg 2394.5円/錠
m3.comにご登録済の方
薬剤名検索
薬剤情報提供:一般財団法人日本医薬情報センター 剤形写真提供:株式会社薬事日報社
・薬剤情報・剤形写真は月一回更新しておりますが、ご覧いただいた時点で最新情報ではない可能性がございます。 最新情報は、各製薬会社のWebサイトなどでご確認ください。
・投稿内容の中に適応外、承認用法・用量外の記載等が含まれる場合がありますが、エムスリー、製薬会社が推奨するものではありません。

 同薬効薬剤
同薬効薬剤

企業ブランド
投稿日: 2019/02/07 参考率: 83%(10人/12人)
外科/40代/処方経験あり